专题:金属及其重要化合物 第2讲 铁及其化合物(1)
【学习目标】
1、 了解铁及其重要化合物的主要物理性质和用途;
2、 了解铁分别与氧气、氯气、水、酸、盐等物质反应的情况;
3、 Fe3+的氧化性,认识Fe3+和Fe2+之间的相互转化,巩固Fe3 +和Fe2+的检验方法;
4、通过对铁及其重要化合物知识的归纳和整理,进一步体会物质变化的一般规律,学习元素化合物知识的一般方法。
【自主回顾】
一、铁的性质
1、你知道铁有哪些应用?分别对应着铁的哪些物理性质?请完成下表,并拍照上传。
2、请回忆铁参与的相关化学反应,填写在下面的横线上并拍照上传。
从氧化还原反应的角度来说,铁均充当 剂。
二、Fe2+与Fe3+的相互转化和检验;
[当堂巩固]
1.下列鉴别物质的方法能达到目的的是( )
A.用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
B.用焰色反应鉴别NaCl固体和NaOH固体
C.用KSCN溶液鉴别FeCl3溶液和FeSO4溶液
D.用丁达尔效应鉴别NaCl溶液和KCl溶液
2.下列反应的离子方程式书写正确的是( )
A.铁粉与稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑
B.Na2CO3溶液与足量盐酸反应:CO32-+2H+=CO2↑+H2O
C.Cu(OH)2固体与稀H2SO4反应:OH-+H+=H2O
D.铝片与NaOH溶液反应:Al+OH-+H2O=AlO2-+H2↑
3.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2 + 14Fe3+ + 8H2O =15Fe2+ + 2SO42—+16H+
加入FeS2还原后,检验Fe3+是否反应完全的试剂为 。
4、有关物质的转化关系如下图所示(部分物质和条件已略去)。B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色。
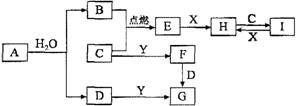
请写出C与H溶液反应的化学方程式:_________________________________________。
